Qualità farmaceutica
Qualifica e convalida
Il principio generale che governa qualunque “sistema” farmaceutico è che l’utilizzatore deve fornire l’evidenza documentale che il sistema sia “qualificato” e che il processo produttivo che in esso risiede sia “convalidato” prima della produzione di prodotto farmaceutico.
Ciò è realizzabile mediante la creazione dei protocolli di convalida secondo lo standard concordato ed approvato dal cliente. Una volta scritti i protocolli si procederà all’ esecuzione delle attività di convalida ovvero l’installation qualification e operation qualification.

- FAT Factory Acceptance Tests (Collaudo del sistema presso il costruttore): test effettuati nello stabilimento di costruzione prima della consegna aventi lo scopo di mostrare che il sistema funziona in modo adeguato da poter essere installato e testato nel sito finale.
- SAT Site Acceptance Tests (Collaudo del sistema presso l’Utilizzatore): test volti a mostrare che il sistema funziona nel proprio ambiente operativo definitivo e che si interfaccia correttamente con altri sistemi e periferiche.
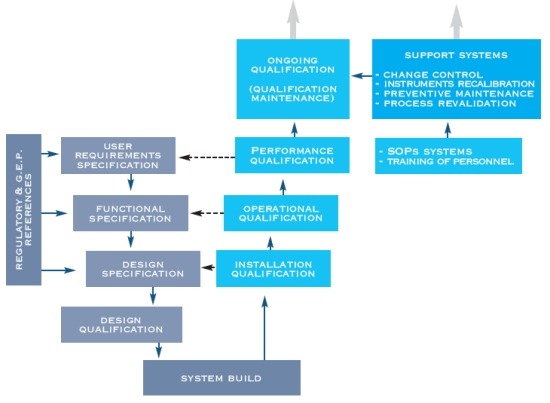
- DQ Design Qualification: verifica documentata che il progetto di impianti, sistemi, equipaggiamenti in oggetto è adatto per lo scopo preposto.
- IQ Installation Qualification: verifica documentata che un sistema è installato secondo specifiche scritte e approvate.
- OQ Operational Qualification: verifica documentata che un sistema opera secondo specifiche approvate nei range di operatività specificati.
- PQ Performance Qualification: verifica documentata che un sistema è in grado di compiere le attività relative a processi da svolgere, in accordo a specifiche scritte e approvate, con finalità il processo e l’ambiente operativo.
- GMP Good Manufacturing Practices (Norme per la buona fabbricazione): sono un insieme di regole, procedure e linee guida in base alle quali vengono prodotti i farmaci, i dispositivi medici, i prodotti per la diagnostica, i cibi e le sostanze farmacologicamente attive.
- GAMP Good Automated Manufacturing Practices: costituiscono l’insieme di ‘good practices’ definite dalla commissione tecnica COP (Community Of Practice) che fa capo alla Società Internazionale di Ingegneria Farmaceutica (ISPE). L’obiettivo della comunita’ e’ quello di promuovere la comprensione del regolamento e l’uso di sistemi automatizzati entro l’industria farmaceutica.
- LIFE CYCLE Tutte le fasi nella vita di un prodotto dal primo sviluppo, attraverso la commercializzazione fino alla dismissione.
- BATH Processo che porta alla produzione di quantità finite di prodotto da materie prime trasformate, in un periodo temporale limitato, attraverso procedure ordinate di trasformazione, utilizzando opportuni equipaggiamenti di impianto.
- S88 Standard ISA S88: definisce la gestione gerarchica per la gestione ricette e la suddiv isione degli ambienti operativi del processo, separando il prodotto da ciò che li crea. Si promuove il riutilizzo e la flessibilità dell’equipaggiamenti e fornisce una struttura per coordinare ed integrare informazioni di ricette attraverso sistemi Enterprise Resource Planning, Manufacturing (ERP), Execution System (MES). Non è uno standard per il software, equipaggiamenti o procedure; piuttosto una filosofia di progetto. Lo scopo è di diffondere la conoscenza e l’esperienza contenuta nello standard per identificare chiaramente i bisogni del cliente e rendere le ricette più semplici da sviluppare.
- ISPE International Society for Pharmaceutical Engineering.
- FDA Food and Drug Administration: In italiano “agenzia per gli alimenti e i medicinali”, e’ l’ente governativo statunitense che si occupa della regolamentazione dei prodotti alimentari e farmaceutici. Dipende dal United States Department of Health and Human Services (il corrispondente dell’italiano Ministero della Sanità). L’FDA ha come scopo la protezione della salute dei cittadini attraverso regolamenti che controllino la messa sul mercato dei prodotti che sono sotto la sua giurisdizione, tra cui i farmaci, gli alimenti, gli integratori alimentari e gli additivi alimentari, i mangimi e farmaci veterinari, le attrezzature mediche, il sangue e gli emoderivati per trasfusioni e i cosmetici.
- FDA 21 CFR PART 11 La normativa FDA 21 CFR Part 11 stabilisce le linee guida per l’espletamento di talune procedure del processo produttivo. È opportuno sottolineare che per la validazione degli ambienti secondo tali linee guida, la normativa non prevede necessariamente l’acquisizione di strumenti specializzati (tool analitici, sistemi di gestione documentale, strumenti di reportistica, ecc.), bensì la verifica che tutte le procedure adottate nel processo rispettino certi requisiti. Riassumendo, possiamo dire che sono quattro i “pilastri” fondamentali della normativa 21 CFR Part 11:
– Sistema di Sicurezza Centralizzato: obbligo di accesso tramite login con username e password personali.
– Differenziazione Automatica dei Ruoli: ad es., un operatore non potrà avere accesso alle medesime funzionalità analitiche e ai medesimi dati a cui potrà invece avere accesso un tecnico-analista. Per banalizzare, ad un operatore potrà essere consentita la visualizzazione di una Carta di Controllo della Qualità (aggiornabile in tempo reale), ma sarà impeditata la visualizzazione di una serie di altre informazioni (statistiche) più dettagliate, quali ad esempio indici di capacità di processo, violazioni di specifiche, andamento dello storico, ecc.
-Sistema Standardizzato di Reportistica: La normativa richiede esplicitamente “La possibilità di generare copie accurate e complete di record leggibili ed in forma elettronica adatte per un controllo/ispezione, rivisitazione, e copia da parte dell’agenzia”. Indispensabile quindi la disponibilità di strumenti software in grado non solo di creare tabelle e grafici modificabili ed esplorabili, ma anche di contenere informazioni di gestione non necessariamente attinenti la fase di analisi.
– Tracciabilità di ogni singola operazione (Audit Trail): Punto cardine della normativa è che OGNI SINGOLA OPERAZIONE deve essere tracciata e far parte di uno storico consultabile in qualsiasi momento in forma di report standard dagli amministratori di sistema o dagli enti certificanti. In altre parole, l’amministratore deve essere in grado di stabilire “chi ha fatto cosa, in quale istante, da quale macchina (e possibilmente per quale motivo)” in forma leggibile ed editabile.

Presto online

Presto online
